플루오린화 수소
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
플루오린화 수소는 HF로 표기되며, 1771년 칼 빌헬름 셸레에 의해 대량으로 제조되었다. 상온에서 기체 또는 액체 상태로 존재하며, 다른 할로겐화 수소에 비해 끓는점이 높고, 수소 결합으로 인해 독특한 성질을 나타낸다. 플루오린화 수소는 유리를 부식시키며, 유기플루오린 화합물, 알루미늄 전해, 금속 플루오린화물, 플루오린 제조, 촉매, 용매 등 다양한 산업 분야에서 사용된다. 플루오린화 수소는 부식성이 강하고 독성이 높아, 노출 시 심각한 건강 문제를 일으킬 수 있으며, 우라늄 농축 및 독가스 제조에 사용될 수 있어 수출 통제 대상이다.
더 읽어볼만한 페이지
- 무기 용매 - 물
물은 산소 원자 하나와 수소 원자 두 개로 이루어진 무기 화합물로, 지구 표면의 약 70%를 차지하며 고체, 액체, 기체 상태로 존재하고 생명체의 필수 구성 요소이자 문명과 밀접한 관련이 있지만 물 부족과 수질 오염 문제가 심각해지고 있다. - 무기 용매 - 이산화 탄소
이산화탄소(CO₂)는 탄소 원자 하나와 산소 원자 두 개로 이루어진 무색·무취의 기체로, 드라이아이스로 승화하며, 탄산 형성, 연소, 호흡, 광합성 등 다양한 과정에서 발생하고, 산업적으로 널리 사용되지만 지구 온난화의 주요 원인이자 고농도에서 인체에 유독한 물질이다. - 플루오린화물 - 헥사플루오로인산
- 플루오린화물 - 아불화 은
아불화 은은 아이오딘화 카드뮴과 결정 구조는 같지만 이온 위치가 반대이며, 은 원자 간 최단 거리는 299.6 pm이다. - 산 (화학) - 왕수
왕수는 진한 질산과 염산을 1:3 몰 비율로 혼합한 것으로, 금이나 백금 같은 귀금속을 녹일 수 있는 강력한 산화력을 가진 용액이며, 염화 금산 제조, 식각, 분석화학 등에 사용된다. - 산 (화학) - 질산
질산은 강산이자 강력한 산화력을 지닌 무색 액체로, 비료, 폭발물, 나일론 생산 등 산업에 널리 쓰이지만 부식성과 테러 악용 위험성도 있으며, 현재는 주로 암모니아 산화법으로 생산된다.
2. 역사
이전부터 플루오린화 수소산은 유리 산업에서 알려져 있었으며, 1771년 스웨덴의 화학자 칼 빌헬름 셸레는 플루오린화 수소산을 대량으로 제조했다. 프랑스의 화학자 에드몽 프레미는 플루오린을 분리하려는 시도 중에 무수 플루오린화 수소(HF)를 발견했다고 알려져 있다.[1]
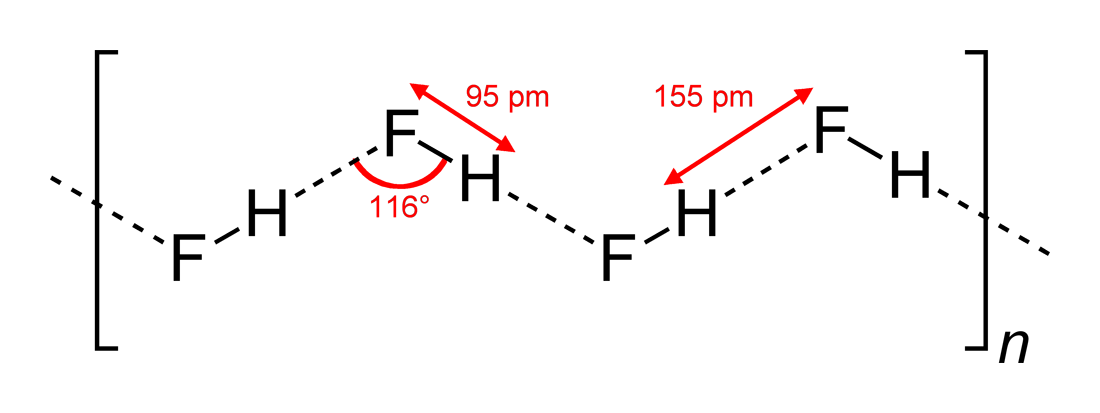
플루오린화 수소(HF)는 이원자 분자이지만, 분자 간에 비교적 강한 수소 결합을 형성한다. 고체 상태에서는 지그재그 형태의 사슬 구조를 가지며, HF 분자 내 H-F 결합 거리는 95pm, 분자 간 거리는 155pm이다.[46] 액체 상태에서도 짧은 사슬 모양을 형성하며, 평균 5~6개의 분자로 구성된다.[47]
3. 구조 및 반응
3. 1. 다른 할로젠화 수소와의 비교
다른 할로젠화 수소(염화 수소, 브로민화 수소, 아이오딘화 수소)는 상온보다 훨씬 낮은 -85°C~-35°C에서 끓는 반면, 플루오린화 수소는 분자 간의 수소 결합 때문에 20°C 정도의 상대적으로 높은 온도에서 끓는다.[48][49][50] HF 분자들 사이의 이러한 수소 결합은 액체 상태에서 높은 점성을 유발하고, 기체 상태에서 예상되는 압력보다 낮은 압력을 발생시킨다. 또한 다른 할로젠화 수소와는 다르게 공기보다 가볍다.
플루오린화 수소는 녹는점 -84°C, 끓는점 19.54°C로, 상온에서는 기체 또는 액체이다. 염화 수소 등 다른 할로젠화 수소에 비해 성질이 다른 점이 있다. 우선, F-H 결합 에너지가 크기 때문에 전리되기 어렵고, 묽은 수용액에서는 약산으로 작용한다. 이는 플루오린화 이온의 이온 반지름이 작기 때문에 수소 이온과의 정전기력이 강하기 때문으로 해석된다. 또한, 수소 결합에 의해 분자 간에 강한 상호 작용을 가지므로, 분자량에 비해 끓는점이 높아진다. 플루오린의 전기 음성도가 너무 크기 때문에, 플루오린화 수소끼리 이합체 또는 그 이상의 다량체를 생성한다. 80°C 이상의 기체 상태에서는 단량체가 주를 이룬다.[21]
3. 2. 수용액
플루오린화 수소의 수용액은 플루오린화 수소산(불산)이라고 불린다. 희석된 플루오린화 수소산은 다른 할로젠화 수소산들과는 달리 약산이다. 그러나 농축된 플루오린화 수소산은 수소 결합된 이온쌍 [H₃O⁺·F⁻]의 형성으로 인하여 강산이다.[52][53] 무수 HF 용액에서는 다음과 같이 자동 이온화가 일어난다.[52][53]
: 3 HF ⇌ H₂F⁺ + HF₂⁻
플루오린화 수소(HF)는 다른 할로젠화 수소와 달리 물과 어떤 비율로든 잘 섞인다. 플루오린화 수소는 -40°C에서 일수화물 HF·H₂O를 형성하며, 이는 순수한 HF의 녹는점보다 44°C 높다.[51]
3. 3. 루이스 산과의 반응
플루오린화 수소(HF)는 루이스 산과 반응하여 초강산 용액을 생성한다. 특히, 오플루오린화 안티모니(SbF5)와 반응하면 하메트 산도 함수(''H''0)가 -21인 플루오로안티몬산 용액이 생성된다.[54][55] 물과 마찬가지로 플루오린화 수소는 약한 염기로 작용하여 루이스 산과 반응해 초강산을 생성할 수 있는데, 안티몬 펜타플루오라이드(SbF5)와 반응하여 플루오로안티몬산을 형성하는 경우가 그 예시이다. 이때 하메트 산도 함수는 -21을 나타낸다.[12][13]4. 제조
플루오린화 수소는 형석(플루오린화 칼슘)에 황산을 가한 다음, 가열해서 제조한다.[58][16]
:CaF2 + H2SO4 → 2 HF + CaSO4
제조된 HF의 약 20%는 비료 생산의 부산물인 헥사플루오린 규산으로부터 제조된다. 헥사플루오린 규산은 열분해 및 가수분해에 의해 분해되어 HF를 방출할 수 있다.
:H2SiF6 → 2 HF + SiF4
:SiF4 + 2 H2O → 4 HF + SiO2
생성된 플루오린화 수소는 유리와 반응하기 때문에, 제조 시 유리로 된 실험기구를 사용하지 않는다.
물에 플루오린을 반응시키면 격렬하게 반응하여 플루오린화 수소와 산소가 생성된다(이 반응 방식은 염소나 브롬과는 다르다).
:2H2O + 2F2 → 4HF + O2
5. 이용
일반적으로 무수 화합물인 플루오린화 수소는 수용액인 플루오린화 수소산보다 산업에 널리 사용된다. 플루오린화 수소는 유기플루오린 화합물의 전구체, 알루미늄의 전기분해를 위한 빙정석의 전구체로 주로 사용된다.[58][16]
플루오린화 수소는 촉매 및 용매로도 사용되며, 유리와 반응하는 성질을 가지기도 한다.
5. 1. 유기플루오린 화합물의 전구체
플루오린화 수소(HF)는 유기 염소화 합물과 반응하여 플루오린화 탄소를 생성한다. 이 반응의 중요한 용도는 테플론의 전구체인 테트라플루오로에틸렌(TFE)을 생성하는 것이다. 클로로포름은 HF에 의해 플루오린화되어 염화이플루오린화메테인(R-22)을 생성한다.[58]:CHCl3 + 2 HF → CHClF2 + 2 HCl
염화이플루오린화메테인의 열분해(550°C~750°C 에서)는 테트라플루오로에틸렌을 생성시킨다.
HF는 유기 화합물의 전기화학적 플루오린화에서 반응성 용매이다. 이 과정에서 HF는 탄화수소의 존재 하에서 산화되고, 플루오린은 C-H 결합을 C-F 결합으로 대체한다. 과플루오린화 카복실산 및 술폰산은 이러한 방법으로 생산된다.[56]
1,1-다이플루오로에테인은 촉매로 수은을 사용하여 아세틸렌에 HF를 첨가하여 생성된다.[56]
:HC≡CH + 2 HF → CH3CHF2
이 공정의 중간생성물은 플루오린화 비닐이며, 폴리플루오린화 비닐의 단량체 전구물질이다.
5. 2. 금속 플루오린화물 및 플루오린 전구체
무수 화합물인 플루오린화 수소는 유기플루오린 화합물 및 알루미늄의 전기분해를 위한 빙정석의 전구체로 사용된다.[58]알루미늄의 전해 채취는 용융된 빙정석에서 플루오린화 알루미늄을 전기분해하는 방식으로 이루어진다. 알루미늄 1톤을 생산할 때마다 수 킬로그램의 플루오린화 수소가 소비된다. 육불화 우라늄을 비롯한 다른 금속 플루오린화물 생산에도 플루오린화 수소가 사용된다.[58]
플루오린화 수소는 플루오린화 수소와 중플루오린화 칼륨 용액을 전기분해하여 얻는 플루오린(F2)의 전구체이다. 무수 플루오린화 수소는 전기를 전도하지 않기 때문에 중플루오린화 칼륨이 필요하다. 이러한 방식으로 매년 수 백만 킬로그램의 F2가 생산된다.[57]
5. 3. 촉매
플루오린화 수소는 정유 공장의 알킬화 공정에서 촉매 역할을 한다. 전 세계에 설치된 대부분의 선형 알킬벤젠 생산 시설에서 사용된다.[58] 이 공정은 ''n''-파라핀의 올레핀으로의 탈수소화 및 플루오린화 수소를 촉매로 사용하는 벤젠과의 후속 반응을 포함한다. 예를 들어, 정유 공장에서 옥테인 휘발유의 구성 성분인 알킬레이트는 C3 및 C4 올레핀과 아이소뷰테인을 결합한 알킬화 단위로 생성된다.[16]5. 4. 용매
단백질과 탄수화물까지도 용해시키는 우수한 용매이다. 수소 결합에 참여하는 플루오린화 수소(HF)의 능력을 반영하여, 단백질과 탄수화물도 플루오린화 수소에 용해되며 회수할 수 있다. 반면, 대부분의 비플루오린화 무기 화합물은 용해되기보다는 플루오린화 수소와 반응한다.[59][17]5. 5. 유리와의 반응
플루오린화 이온의 높은 친핵성에 의한 규소 원자와의 강한 결합 형성 및 규산 골격에 대한 양성자화의 상호 작용으로 인해, 유리 등에 포함된 이산화 규소(SiO₂)와 반응하여 육플루오로규산()을 생성하여 이것들을 부식시킨다. 이 반응은 반도체 제조 공정에서 중요하다.:
기체 플루오린화 수소는 유리 등에 포함된 이산화 규소와 반응하여 사플루오린화 규소를 생성한다.
:
6. 산으로서의 성질
다른 할로젠화 수소산과 달리 플루오린화 수소산은 수용액 상태에서 약산으로 존재한다.[60] 이는 H-F 간의 결합이 강한 것도 있지만, H2O와 F− 이온이 이온쌍을 형성하여 자유 하이드로늄 이온이 적어지기 때문이다. 고농도에서 플루오린화 수소 분자는 호모어소시에이션 현상을 겪어 바이플루오라이드와 같은 다원자 이온과 양성자들을 형성하여 산성도가 높아진다.[61] 이로 인해 농축된 플루오린화 수소산 용액은 염화 수소산, 황산, 질산과 같은 강산의 양성자 첨가 반응을 일으킨다.[62]
플루오린 이온의 수소 결합으로 인해 플루오린화 수소산의 산성도는 농도에 따라 달라진다. 희석된 용액의 경우 산 해리 상수 ''K''a = 6.6 (p''K''a = 3.18)[63]을 나타낸다. 이는 다른 할로젠화 수소 수용액들이 강산인 것(p''K''a < 0)과 대비된다. 농축된 플루오린화 수소산의 경우 훨씬 강한 산성을 띠는데 하메트 산도 함수(Hammett acidity function, ''H''0)를 통해 나타낸다.[64] 순수한 플루오린화 수소산의 ''H''0 값은 −10.2에서 −11 사이로, −12인 황산과 비슷하다.[54][55]
열역학적인 관점에서 보면, 플루오린화 수소 용액은 비이상 용액으로 실제 농도보다 HF의 활동도가 더 빠르게 증가한다. 희석된 용액에서 낮은 산성도는 높은 H-F의 결합력에 기인하는데, 이는 플루오린화 수소의 높은 용해 엔탈피가 플루오린화 이온의 음의 수화 엔탈피보다 크게 작용하기 때문이다.[65]
농축된 용액에서, 플루오린화 수소의 첨가는 이온쌍이 수소 결합을 하는 플루오린화 수소 이온(HF2−)을 형성하도록 하는 효과가 있다.[66][68]
:[H3O+⋅F−] + HF H3O+ +
이 반응을 통한 자유 하이드로늄 이온의 증가는 플루오린화 이온이 플루오린화 수소 이온을 형성하면서 안정화되는 동안 나타나는 급격한 산성도 증가를 설명한다. 이 산과 짝염기의 상호작용은 호모공역의 한 예로 볼 수 있다. 순수한 플루오린화 수소 액체에서는 자동 이온화가 일어난다.[69][70]
:3 HF H2F+ +
플루오린화 수소의 수용액(플루오르화 수소산, 불산)은 농도에 따라 산성도가 현저하게 변화하며, 순수한 플루오린화 수소에서는 하메트의 산도 함수는 ''H''0 = −11.03을 나타내며, 순수한 황산에 가까운 강산성 매체이다.[23]
7. 건강에 미치는 영향
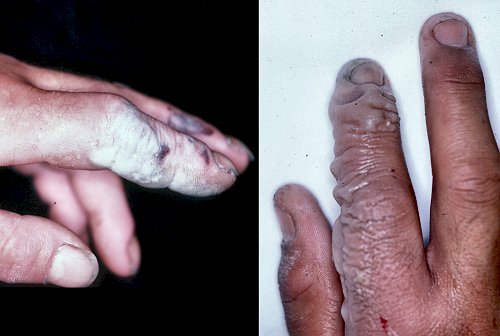
플루오린화 수소는 부식성이 강하고 강력한 접촉 독으로, 체내 수분과 접촉하면 부식성이 높고 독성이 강한 플루오린화 수소산이 생성된다. 그러므로 플루오린화 수소에 노출되면 즉시 응급 처치를 해야 한다.[71] 플루오린화 수소는 각막을 빠르게 파괴하여 실명을 유발할 수 있다. 고농도의 플루오린화 수소를 들이마시거나 피부에 닿으면 심장 부정맥이나 폐부종(폐에 체액 축적)으로 사망에 이를 수 있다.[71][18]
산업안전보건법의 제2류 특정 화학 물질로 지정되어 있다.
사람의 경구 최소 치사량은 1.5g, 또는 체중당 20mg/kg이다. 숟가락 한 숟가락의 9% 용액을 잘못 마셔 사망한 사례도 있다.[32] 흡입하면 작열감, 기침, 현기증, 두통, 호흡 곤란, 메스꺼움, 숨 가쁨, 인후통, 구토 등의 증상이 나타난다. 눈에 들어가면 발적, 통증, 심한 화상을 일으킨다. 피부에 접촉하면 체내로 쉽게 침투한다. 불화 수소는 체내의 칼슘 이온과 결합하여 불화 칼슘을 생성하는 반응을 일으키므로 뼈를 침범한다. 농도가 옅은 불화 수소산이 부착되면 수 시간 후에 욱신거리는 통증에 시달리는데, 이는 생성된 불화 칼슘결정의 자극 때문이다. 또한, 많이 뒤집어쓰면 죽음에 이르는데, 이는 혈액 중의 칼슘 이온이 불화 수소에 의해 급속히 소비되기 때문에 혈중 칼슘 농도가 저하되어 종종 심각한 저칼슘 혈증을 일으키기 때문이다.[33] 이 경우 의식은 명확한 채로 심실 세동을 일으켜 사망한다.[34]
치과 치료에서는 인공 치아(의치) 제조 과정에 불화 수소가 사용되는 한편, 치아 우식(충치) 예방에 불화나트륨(NaF)이 사용되는 경우가 있다. 둘 다 불화물이므로 혼동될 위험이 있다. 실제로, 양자를 잘못 사용하여 발생한 사망 사고(하치오지시 치과의사 불화 수소산 오도포 사고)가 보고되고 있다.[35][36]
피부에 접촉한 경우의 응급 처치로는 즉시 흐르는 물로 세척하고 글루콘산 칼슘을 환부에 도포한다.
8. 반도체에서의 이용
2019년 한일 무역 분쟁으로 고순도 플루오린화 수소(에칭가스)가 주목받았다.[1]
대한민국에서는 후성, 솔브레인, 이엔에프테크놀로지, 원익머트리얼즈 등이 플루오린화 수소를 생산하지만, 일본 업체에서 원재료를 수입하여 정제하는 경우가 많다.[1] 삼성전자와 SK하이닉스는 일본 스텔라 케미파, 모라타화학공업 등에서 고순도 에칭가스를 직접 수입하거나, 국내 협력업체가 일반 플루오린화 수소를 고순도로 가공한 제품을 구매한다.[1]
일본 정부는 한국 기업이 수입한 에칭가스를 북한으로 수출하였다고 주장했으나, 이는 고순도 플루오린화 수소가 아닌 일반 플루오린화 수소에 해당할 가능성이 높다.[1] 독가스 생산이나 우라늄 농축에는 저순도 플루오린화 수소(순도 97% 안팎)가 사용되기 때문이다.[1]
9. 환경 문제 및 규제
플루오린화 수소는 우라늄 농축[27]이나 사린 등 독가스 제조[28]에 사용되기 때문에, 생물 화학 무기 관련 오스트레일리아 그룹의 규정에 따라 수출이 통제되는 품목이다.[37] 일본에서는 외국환 및 외국 무역법에 의해 경제산업대신의 허가 없이는 수출할 수 없다.
일본 법령상으로는 정령인 수출무역관리령 별표 제1의 3항 (1)에서 "군용 화학 제제의 원료가 되는 물질 또는 군용 화학 제제와 동등한 독성을 가진 물질 또는 그 원료가 되는 물질로서 경제산업성령으로 정하는 것"에 해당한다.[38] 플루오린화 수소는 이 정령에 언급된 경제산업성령인 수출무역관리령 별표 제1 및 외국환령 별표의 규정에 의거하여 화물 또는 기술을 정하는 성령(화물 등 성령) 제2조 1항의 "헤"에 게재되어 있다.[39]
10. 사고 사례
1970년 9월 8일, 지바현 이치카와시의 소부 본선 가드에 탱크로리가 충돌하여 탱크 위 밸브가 파손되면서 적재된 플루오린화 수소가 누출되었다. 이 사고로 현장에 출동한 소방관, 지역 주민 등 60명 이상이 화상을 입었다.[40]
1982년 4월 20일, 도쿄도 하치오지시의 한 치과에서 치과의사가 충치 예방용 플루오린화 나트륨(NaF) 대신 플루오린화 수소산을 당시 3세 여아의 치아에 도포하여 급성 약물 중독으로 사망하게 하는 사건이 발생했다. 치과의사는 업무상 과실치사죄로 금고 1년 6개월, 집행유예 4년의 유죄 판결을 받았다.[41]
2012년 9월 27일, 대한민국 경상북도 구미시에 있는 공장에서 플루오린화 수소산이 누출되는 사고가 발생하여, 작업자 5명이 사망하고 주민 4천여 명이 건강 피해를 입었다. 대한민국 정부는 같은 해 10월 8일 경상북도 구미시 산동면 봉산리 일대를 특별재난지역으로 지정했다.[42]
참조
[1]
웹사이트
pKa's of Inorganic and Oxo-Acids
http://ccc.chem.pitt[...]
2020-06-19
[2]
문서
PGCH
[3]
문서
Hydrogen fluoride
[4]
논문
The Crystal Structure of Deuterium Fluoride
[5]
논문
On the Structure of Liquid Hydrogen Fluoride
[6]
서적
The Nature of the Chemical Bond and the Structure of Molecules and Crystals: An Introduction to Modern Structural Chemistry
https://archive.org/[...]
Cornell University Press
[7]
서적
Chemical principles: The quest for insight
https://books.google[...]
W. H. Freeman & Co
[8]
논문
The hidden strength of hydrogen
https://web.archive.[...]
2012-12-25
[9]
서적
Chemistry of the Elements
Butterworth Heinemann
1998
[10]
서적
Inorganic Chemistry
[11]
서적
Advanced Inorganic Chemistry
[12]
서적
Modern Inorganic Chemistry
McGraw-Hill
[13]
서적
Advanced Inorganic Chemistry
John Wiley and Sons
[14]
간행물
Fluorine Compounds, Organic
[15]
간행물
Fluorine
[16]
간행물
Fluorine Compounds, Inorganic
[17]
서적
Chemistry of the Elements
[18]
웹사이트
Facts About Hydrogen Fluoride (Hydrofluoric Acid)
http://emergency.cdc[...]
[19]
논문
The NBS tables of chemical thermodynamics properties
[20]
논문
無水フッ化水素
有機合成化学協会
1967
[21]
서적
コットン・ウィルキンソン無機化学
培風館
[22]
서적
溶液内の化学反応と平衡
丸善
[23]
논문
Acidity functions: an update
Canadian Science Publishing
1983
[24]
웹사이트
アルキレーション (あるきれーしょん)
https://oilgas-info.[...]
石油天然ガス・金属鉱物資源機構
2019-11-02
[25]
뉴스
輸出優遇除外:ロシアのフッ化水素供給提案に韓国業界は困惑
http://www.chosunonl[...]
朝鮮日報
2019-07-13
[26]
웹사이트
朴智元議員「日本は129フッ化水素生産計画…文大統領は検討を」
https://japanese.joi[...]
[27]
웹사이트
転換処理
https://www.jsme.or.[...]
日本機械学会
[28]
뉴스
「日本、経済報復の世論戦のために自国民のトラウマ『サリン』まで活用」
https://japanese.joi[...]
2019-07-10
[29]
웹사이트
経済産業省生産動態統計
https://www.meti.go.[...]
経済産業省
[30]
웹사이트
TVEL Fuel Company
https://www.tvel.ru/[...]
[31]
웹사이트
Stock Company «Production Association «Electrochemical plant»
http://www.ecp.ru/en[...]
[32]
웹사이트
(財)日本中毒情報センター:フッ化水素(医師向け中毒情報)
http://wwwt.j-poison[...]
[33]
웹사이트
フッ化水素酸中毒の症例
http://www.jichi.ac.[...]
[34]
서적
中毒百科
南江堂
[35]
뉴스
読売新聞
1982-04-22
[36]
간행물
日医総研ワーキングペーパー No.93
http://www.jmari.med[...]
日医総研
2022-03-21
[37]
웹사이트
国問研戦略コメント(No.11) 韓国向け輸出管理の運用見直しについて
https://www2.jiia.or[...]
日本国際問題研究所
2021-08-14
[38]
웹사이트
輸出貿易管理令
https://laws.e-gov.g[...]
2021-08-14
[39]
웹사이트
輸出貿易管理令別表第一及び外国為替令別表の規定に基づき貨物又は技術を定める省令
https://laws.e-gov.g[...]
2021-08-14
[40]
뉴스
猛毒フッ化水素、民家襲う 60数人、やけどや炎症 事故トラックから噴出
朝日新聞
1970-09-08
[41]
간행물
判例タイムズ 678号60頁
[42]
웹사이트
フッ酸漏えいの亀尾地域、特別災難地域に指定
http://japanese.dong[...]
2012-10-10
[43]
웹사이트
pKa's of Inorganic and Oxo-Acids
http://ccc.chem.pitt[...]
2020-06-19
[44]
문서
PGCH 0334
[45]
문서
Hydrogen fluoride
[46]
저널
The Crystal Structure of Deuterium Fluoride
[47]
저널
On the Structure of Liquid Hydrogen Fluoride
[48]
서적
The Nature of the Chemical Bond and the Structure of Molecules and Crystals: An Introduction to Modern Structural Chemistry
https://books.google[...]
Cornell University Press
[49]
서적
Chemical principles: The quest for insight
https://books.google[...]
W. H. Freeman & Co
[50]
저널
The hidden strength of hydrogen
https://books.google[...]
2012-12-25
[51]
서적
Chemistry of the Elements
Butterworth Heinemann
1998
[52]
서적
Inorganic Chemistry
[53]
서적
Advanced Inorganic Chemistry
[54]
서적
Modern Inorganic Chemistry
McGraw-Hill
[55]
서적
Advanced Inorganic Chemistry
John Wiley and Sons
[56]
Ullmann
Fluorine Compounds, Organic
[57]
Ullmann
Fluorine
[58]
Ullmann
Fluorine Compounds, Inorganic
[59]
서적
Chemistry of the Elements
[60]
웹사이트
The acidity of the hydrogen halides
http://www.chemguide[...]
2011-09-04
[61]
서적
Modern inorganic chemistry (An intermediate text)
http://files.rushim.[...]
The Butterworth Group
2017-01-30
[62]
서적
Course in chemistry for IIT-JEE 2011
https://books.google[...]
Tata McGraw Hill Education Private Limited
[63]
서적
General chemistry: principles and modern applications
https://books.google[...]
Pearson/Prentice Hall
2011-08-22
[64]
저널
The Hammett Acidity Function H0for Hydrofluoric Acid Solutions1
[65]
서적
Inorganic Chemistry
Pearson Prentice Hall
[66]
저널
The nature of hydrofluoric acid. A spectroscopic study of the proton-transfer complex H3O+...F−
[67]
저널
Spectral Signatures and Molecular Origin of Acid Dissociation Intermediates
[68]
서적
Advanced Inorganic Chemistry
[69]
서적
Inorganic Chemistry
[70]
서적
Advanced Inorganic Chemistry
[71]
웹사이트
Facts About Hydrogen Fluoride (Hydrofluoric Acid)
http://emergency.cdc[...]
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com



